L'analyse du 14C est devenue un outil indispensable dans de nombreuses disciplines.
Quelques exemples :
| Carbone 12 | Carbone 13 | Carbone 14 | |
|---|---|---|---|
| Abondance | ~ 98,99 % | ~ 1,11 % | 1.2x10-12 |
| Neutrons | 6 | 7 | 8 |
| Protons | 6 | 6 | 6 |
| Signe distinctif | isotope stable, le plus abondant (ne se désintègre pas) | isotope stable (ne se désintègre pas) | isotope radioactif ( avec une période radioactive de 5 730 ans) |
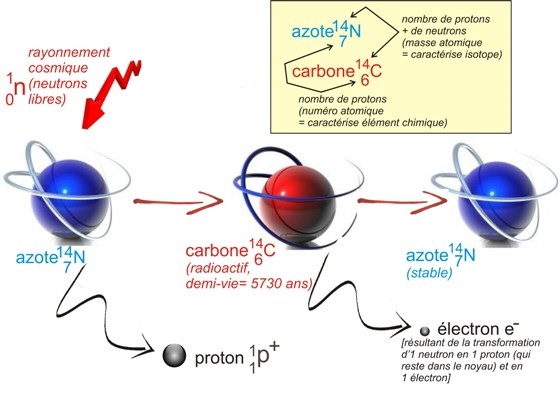
D'où vient le carbone 14 ?
Le carbone 14 a pour origine l'interaction des particules cosmiques avec l’atmosphère terreste. Ces particules, quand elles pénètrent dans la haute atmosphère, brisent les noyaux qu'elles rencontrent. Dans la collision, des neutrons sont libérés. Ces neutrons rencontrent à leur tour un noyau d'azote de l'air. Ils s'introduisent dans ce noyau, provoquant l'expulsion d'un proton et une transmutation en carbone 14.
 Source image : http://www.les-crises.fr/climat-13-les-cycles-solaires-2/
Source image : http://www.les-crises.fr/climat-13-les-cycles-solaires-2/
Histoire et principe de la méthode
Le premier scientifique qui s'est intéressé à la question est Willard Libby (1908-1980) qui reçut en 1962 le prix Nobel pour ses recherches sur le carbone 14, élément radioactif connu depuis les travaux des époux Curie.
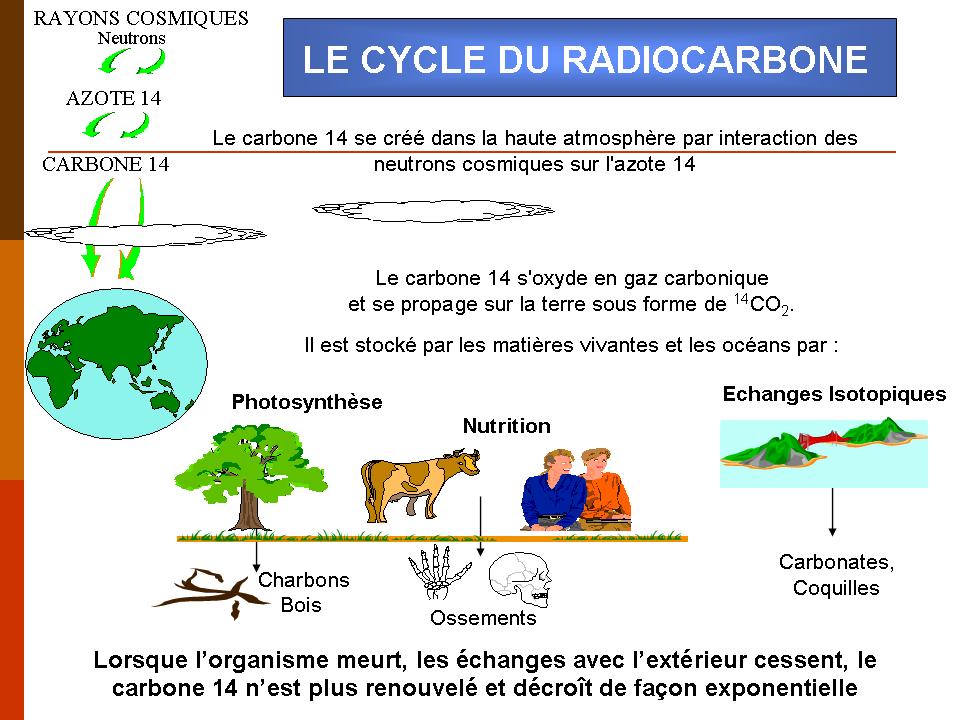
Le carbone est un élément présent dans l'air que nous respirons et dans les aliments que nous consommons. Le carbone est constitué de 3 isotopes dont le carbone 14, qui est radioactif. Lorsqu'un organisme vivant meurt, il arrête de consommer du carbone 14 et donc la quantité présente dans cet organisme commence à diminuer suivant la loi de décroisance radioactive (voir ci-dessous).
Libby est parti de l'hypothèse que si l'on pouvait déterminer la quantité de carbone 14 présente dans un organisme lors de sa mort, on pouvait également déterminer depuis combien de temps il était mort en comptant le nombre d'atomes de carbone 14 encore présent dans cet organisme et donc proposer une datation.
 Source image : Christine Oberlin - centre de Datation par le radiocarbone – UMR5138
Source image : Christine Oberlin - centre de Datation par le radiocarbone – UMR5138
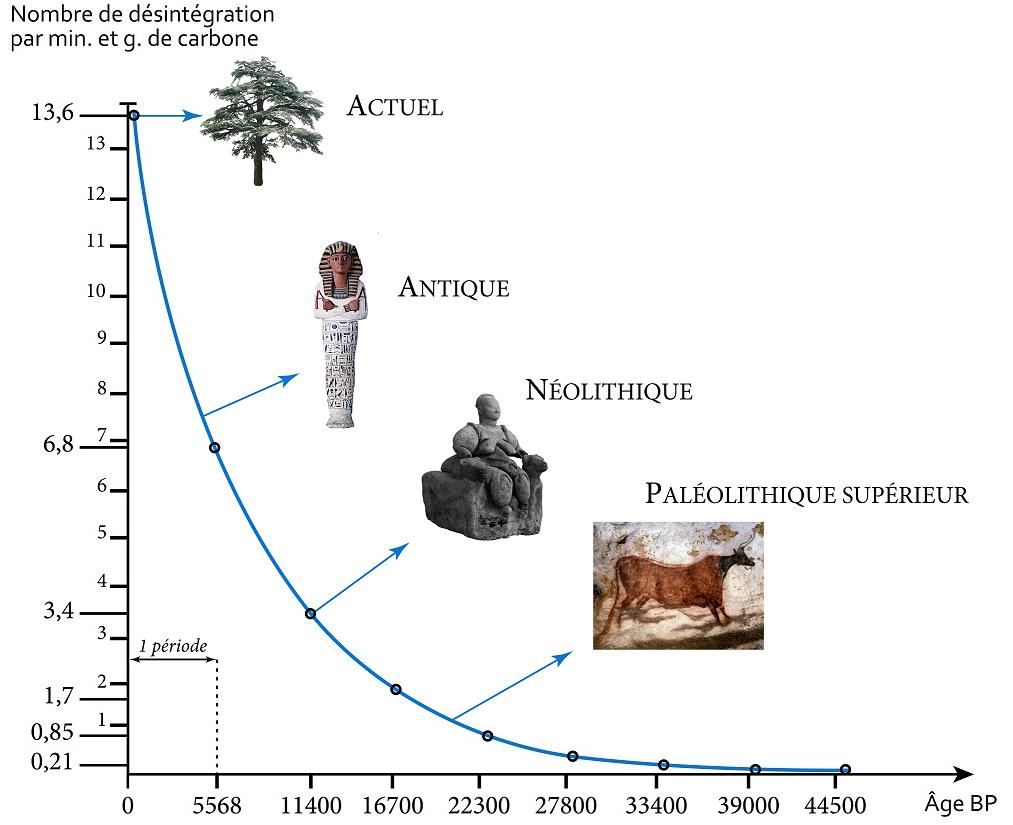
Le carbone 14 est radioactif, autrement dit il se désintègre et disparaît progressivement. Sa demi-vie, également appelée période radioactive, est de 5 730 ans, c’est-à-dire que 5 730 ans après la mort de l’individu il ne restera que la moitiéde son 14C incorporé de son vivant, après 11 460 ans, il n'en restera que le quart, etc. Après 4 ou 5 périodes de demi-vie, il ne restera plus que très peu de 14C avec une limite de détection pour cette méthode avoisinant les 50 Ka.
Lorsqu'on veut effectuer la datation d'un échantillon, le nombre de noyaux de carbone 14 encore présents est mesuré. Cette analyse, permet de déterminer le nombre de périodes de désintégration écoulées et d’ainsi remonter à l’âge de l’échantillon.
La désintégration radioactive ne s’applique pas qu'au carbone 14.
Chaque isotope radioactif a une période radioactive mais selon les atomes radioactifs concernés, cette période est très variable: quelques secondes, heures... plusieurs jours... centaines d'années... ou milliards d'années.
 Source image : http://www.ciram-art.com/fr/objet-art/bois.html
Source image : http://www.ciram-art.com/fr/objet-art/bois.html





